Sitio web de Felix Olasagasti

En mi trabajo de investigación estudio, entre otros, sistemas compuestos por ácidos nucleicos y lípidos. Debido a las interacciones que pueden surgir entre estos dos tipos de moléculas pueden aparecer propiedades nuevas que van más allá de la suma de las propiedades individuales de sus componentes. El análisis teórico y experimental de estas propiedades puede proporcionar indicios sobre la evolución química que condujo a la formación de las primeras células vivas, así como posibles aplicaciones biotecnológicas y farmacéuticas novedosas.
Evolución química prebiótica
La vida apareció en la Tierra hace unos 3.800 millones de años, al final del eón Hadeico. Para entonces, la temperatura de la Tierra se había enfriado lo suficiente como para poder tener agua líquida. Junto con el agua, habría continentes formados por minerales provenientes de los planetesimales y meteoritos que se agregaron en la Tierra.
 Aspecto de la Tierra en el eón Hadeico (más o menos cuando aparecio la vida). (Imagen: Peter Sawyer;
Instituto Smithsonian)
Aspecto de la Tierra en el eón Hadeico (más o menos cuando aparecio la vida). (Imagen: Peter Sawyer;
Instituto Smithsonian)
Las primeras células vivas serían mucho más simples que las actuales. A aquellas primeras células se las llama protocélulas. Las protocélulas, en su base, serían seguramente vesículas de lípidos y en su interior, entre otras substancias, existirían moléculas catalizadoras y moléculas capaces de almacear información. De hecho, es posible que estas dos funciones fuesen llevadas a cabo por el mismo tipo de molécula. Algunas moléculas de RNA, por ejemplo, pueden llevar a cabo ambas funciones y debido a esto, se ha propuesto la existencia de una época basada en el RNA: el mundo RNA.
Por lo tanto, para formar protocélulas habrían hecho falta lípidos y ácidos nucleicos. Para comprender de dónde surgieron, hay que tener en cuenta que llegaban muchos meteoritos a la Tierra en aquella época y que además de minerales, también aportaban muchas substancias orgánicas. Además, ocurrían reacciones químicas durante todo el tiempo y los lípidos y mononucleotidos pudieron formarse gracias a estas vías. Los lípidos pueden formar vesículas de forma espontánea en un medio acuoso, y se pueden sintetizar polinucleotidos (como por ejemplo, RNA) partiendo de mononucleotidos. Pero, ¿cómo se juntaron todas estas moléculas para formar las primeras protocélulas?
Para responder a esta pregunta, en primer lugar, hay que aclarar cómo se formaron los ácidos nucleicos. Para la formación de los ácidos nucleicos, los mononucleotidos deben polimerizar mediante reacciones de condensación. En estas reacciones de condensación se unen dos moléclas y sale (habitualmente) una molécula de agua. Sin embargo, en un medio acuoso, existe una gran cantidad de agua en el entorno y no es fácil que se elimine una molécula de agua sin más. Por otra parte, en algunos entornos aledaños a las masas de agua del Hadeico, existirían entornos que estaban a veces sumergidos y a veces secos. Los mononucleotidos del agua podrían haberse concentrado en estas zonas.
Si se secan mononucleotidos sin más, forman sólidos amorfos. Por otra parte, si se secan lípidos en conjunto con los mononucleotidos, los lípidos pueden formar una fase multilamelar (es decir, de muchas capas), atrapar mononucleotidos en medio y ordenarlos. Bajo estas circunstancias, aunque la movilidad de los mononucleotidos está reducida, todavía pueden moverse en dos dimensiones (entre las capas de lípido); dado que la fase multilamelar de los lípidos sigue siendo fluida en el medio seco. De esta forma, los mononucleotidos pueden llegar a situarse a la distancia y posición adecuadas entre ellos, y dado que la mezcla esta secá, podrían polimerizar por condensación.
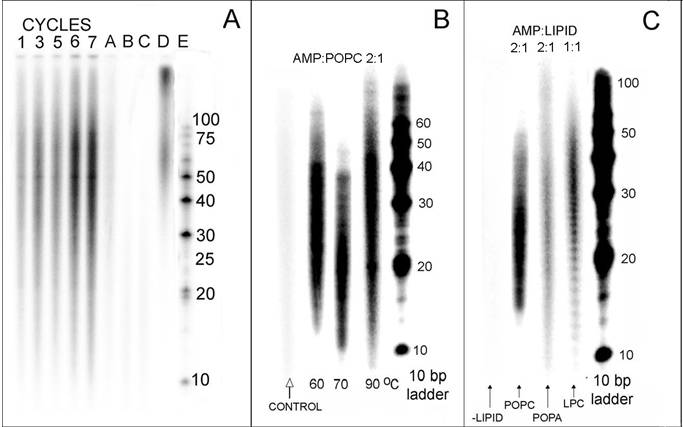 La imagen muestra el análisis de los polinucleotidos obtenidos al secar y calentar mononucleotidos bajo una atmósfera de
CO2. Se pueden ver los geles de PAGE con los productos marcados por 32P.
La imagen muestra el análisis de los polinucleotidos obtenidos al secar y calentar mononucleotidos bajo una atmósfera de
CO2. Se pueden ver los geles de PAGE con los productos marcados por 32P.
La imagen superior muestra algunos resultados obtenidos en experimentos de laboratorio. Vimos que se podían producir polinucleotidos a partir de mononucleotidos no activados en un medio con lípidos y que, si añadimos un polinucleotido a la mezcla de reación, la secuencia del nuevo polinucleotido que se sintetiza es complementaria al polinucleotido inicial. Es decir: vimos que bajo estas circunstancias, la información de secuencia puede pasar de un polinucleotido a otro.
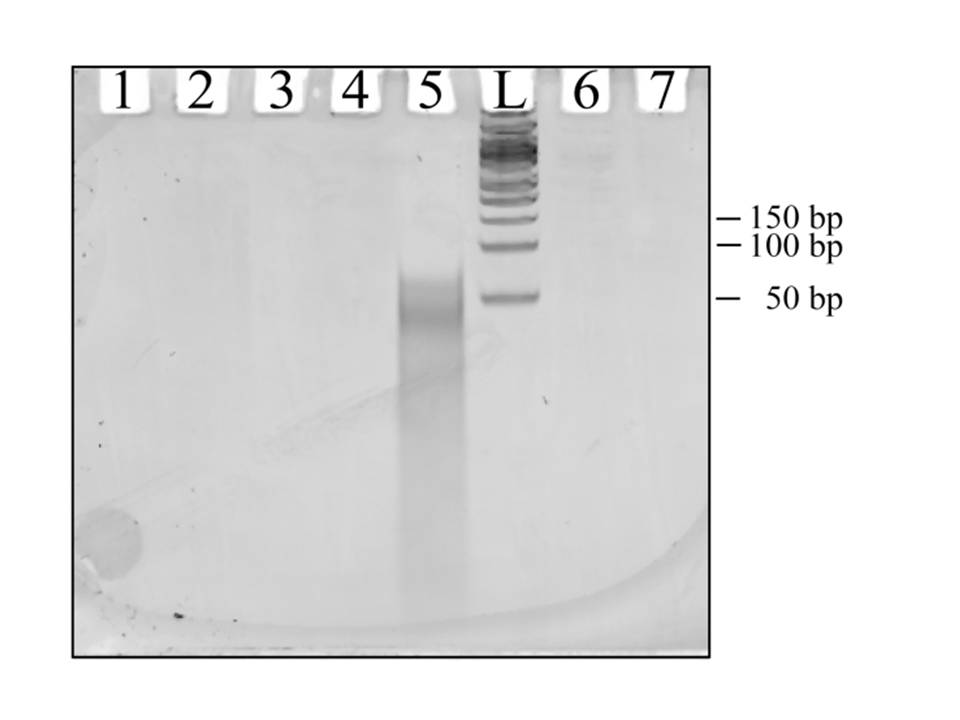 PAGE no-desnaturalizante para mostrar hasta qué punto hibridan de forma específica el producto de la reacción prebiótica y el polinucleotido
utilizado como molde: L: marcador de tamaño de 50 bp hasta 1350 bp; 1: Sólo monomeros (dNMPs); 2: dNMPs y el polinucleotido molde,
pero sin ciclos de reacción; 3: Producto, sin molde; 4: Hibridación no-específica entre el producto y el polinucleotido molde;
5: Hibridación específica entre el producto de la reacción y polinucleotido molde; 6: Sin lípidos; 7: dNMPs + polinucleotido molde,
pero sin ciclos de reacción. Como se puede ver, sólo aparece de forma prominente la hibridación específica. En este caso, la
longitud del polinucleotido molde era de 64 nucleotidos y como parece en la imagen, la distribución de productos también tiene
aproximadamente ese límite superior.
PAGE no-desnaturalizante para mostrar hasta qué punto hibridan de forma específica el producto de la reacción prebiótica y el polinucleotido
utilizado como molde: L: marcador de tamaño de 50 bp hasta 1350 bp; 1: Sólo monomeros (dNMPs); 2: dNMPs y el polinucleotido molde,
pero sin ciclos de reacción; 3: Producto, sin molde; 4: Hibridación no-específica entre el producto y el polinucleotido molde;
5: Hibridación específica entre el producto de la reacción y polinucleotido molde; 6: Sin lípidos; 7: dNMPs + polinucleotido molde,
pero sin ciclos de reacción. Como se puede ver, sólo aparece de forma prominente la hibridación específica. En este caso, la
longitud del polinucleotido molde era de 64 nucleotidos y como parece en la imagen, la distribución de productos también tiene
aproximadamente ese límite superior.
Los compuestos formados mediante estas reacciones de sintesis producirían protocélulas al cabo del tiempo. En estas estructuras, las velocidades de síntesis y degradación de distintos compuestos deberían tener relaciones apropriadas entre ellos para asegurar la estabilidad cinética de todo el sistema. Para estudiar su cinética, se pueden plantear algunas reacciones fundamentales expresando sus velocidades mediante ecuaciones diferenciales ordinarias, y analizar las condiciones necesarias para la estabilidad cinética del sistema.
Utilización biotecnológica de membranas lipídicas y ácidos nucleicos
Vesículas de lípidos como transportadores de otras substrancias
Los lípidos pueden formar vesículas en medios acuosos y dentro de estas vesículas se pueden transportar ácidos nucleicos y otras substancias. El transporte de medicamentos y otras substancias en estructuras lipídicas es una estrategia que se usa desde hace tiempo. Por ejemplo, si estas substancias son medicamentos que deben llegar a un órgano o tejido específico del cuerpo humano, los lípidos pueden proteger estos medicamentos para que no se degraden antes de llegar a donde deben llegar. Por otra parte, una vez han llegado a su destino, el medicamento debe salir de la vesícula y actuar en el órgano. Por lo tanto, esta tecnología se desarrolla buscando el equilibrio entre estos dos efectos: por un lado, las substancias de dentro de las vesículas deben salir lo menos posible hasta llegar a su destino, y por otra parte, una vez llegados, deben salir en la mayor medida posible para poder llevar a cabo el efecto deseado.
Una estrategia para obtener este equilibrio consiste en poner ácidos nucleicos en el exterior de las vesículas. Al igual de lo que ocurre con las proteínas, loa ácidos nucleicos pueden adquirir estructuras tridimensionales distintas dependiendo de su secuencia. De hecho, las proteínas son más versátiles que los ácidos nucleicos y se podría pensar que serían más útiles para este fin. Sin embargo, existe un número mayor de técnicas disponibles para trabajar in vitro con ácidos nucleicos y esto favorece el uso de ácidos nucleicos. Por ejemplo, existe el procedimiento denominado SELEX para la selección de ácidos nucleicos in vitro y las moléculas seleccionadas de esta forma se pueden situar en el exterior de vesículas. Al llegar al tejido en el que debe incidir, los ácidos nucleicos de las vesículas pueden tener interacciones específicas con esa diana y esto puede producir que las sustancias del interior se liberen.
Menbranas de lípidos para el análisis de ácidos nucleicos por nanoporo
La alpha hemolisina es una toxina que segrega la bacteria S. aureus. Entra en la membrana de los eritrocitos, produce agujeros y mata la célula. Los agujeros producidos por esta toxina son justo del tamaño suficiente como para dejar pasar una hebra de ácido nucleico. Gracias a esto, se puede realizar el análisis de ácidos nucleicos y podría llegar utilizarse incluso con fines analíticos clínicos.
Después de que se introduzca la toxina en una membrana formada por lípidos y se aplique una corriente eléctrca, los iones que existen en la disolución producen una corriente eléctrica y esta corriente se puede medir utilizando los apatos electrónico apropiados. Si se pone una disolución que contenga ácidos nucleicos en el polo negativo, el potencial eléctrico establecido desde el exterior hace que estas moléculas atraviesen el poro. Al atraversar el poro, los ácidos nucleicos obstruyen el paso de los iones y la corriente sufre una bajada momentánea. Esta bajada se debe al bloqueo del poro y cada ácido nucleico (o cada complejo formado por ácidos nucleicos y otras moléculas) bloquea el poro de una forma distinta. Por lo tanto, la bajada de la corriente también es distinta y a partir de esa bajada se pueden estudiar propiedades de los ácidos nucleicos (o de complejos formados por ácidos nucleicos y otras moléculas). En particular, se puede estudiar la intensidad de la interacción, así como obtener información sobre la posición relativa de los ácidos nucleicos o de su secuencia.
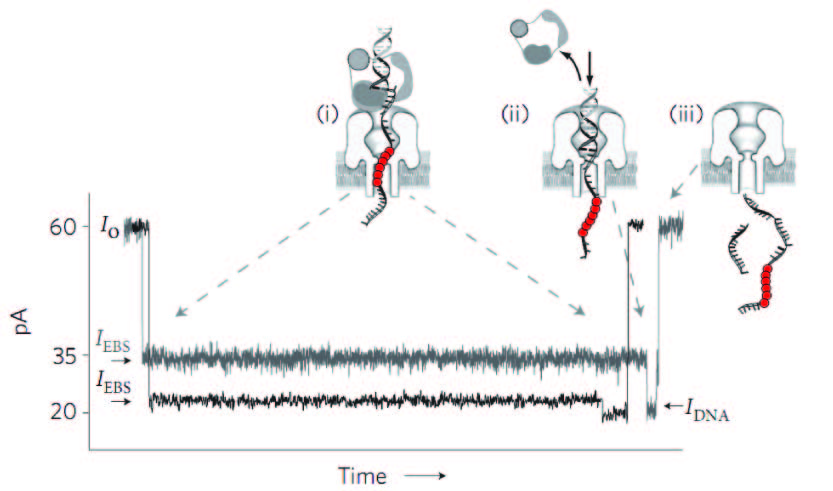 Esta imagen muestra el efecto de diversos complejos moleculares sobre la corriente eléctrica.
Esta imagen muestra el efecto de diversos complejos moleculares sobre la corriente eléctrica.
Metilación de m6A en ARN y su conexión con el cáncer
El carcinoma ductal invasivo (CDI) es una enfermedad compleja y heterogénea. Existen 5 subtipos relevantes: basal, luminal A y B, lumina B-HER2 y HER2-positivo, que varían en prevalencia y pronóstico. El equipo de investigación de esta línea de investigación ha demostrado cómo diferentes patrones de metilación del ADN están asociados a diferentes subtipos de IDC. Sin embargo, todavía no se ha estudiado el papel de la metilación del ARN en el desarrollo y progreso de estos subtipos. La N6-metiladenosina (m6A) es una de las modificaciones más comunes en el ARNm eucariota. Se produce a lo largo del transcriptoma y se observó que las modificaciones de m6A están relacionadas con varios procesos biológicos.
Del mismo modo, las proteínas que producen, eliminan o se unen a m6A están estrechamente relacionadas con varias afecciones, incluido el cáncer. En este sentido, una mejor comprensión de los mecanismos moleculares que interfieren en la metilación del ARNm podría ayudar al descubrimiento de nuevas dianas terapéuticas relacionadas con el patrón de m6A y proporcionar nuevos métodos terapéuticos. También es posible que diferentes subtipos de carcinoma invasivo difieran en su estado de metilación de ARNm.
En este proyecto pretendemos identificar las posiciones m6A del transcriptoma en tejidos tumorales de diferentes subtipos de IDC con el fin de encontrar tratamientos/medidas terapéuticas y fármacos que ayuden a combatir la enfermedad.
Participantes: Felix Olasagasti y miembros del grupo de investigación BIOMICS dentro del clúster Microfluidos y BIOMICS.