Felix Olasagastiren webgunea

Nire ikerketa-lanean, besteak beste, azido nukleikoz eta lipidoz osatutako sistemak ditut aztergai. Bi biomolekula mota hauen artean sor daitezkeen elkarrekintzen eraginez, beren osagaien ezaugarriak gainditzen dituzten propietate berriak ere ager daitezke. Propietate hauen azterketa teoriko eta esperimentala eginez, batetik lehen zelula bizidunak sortu arte materiak egin zuen eboluzio kimikoaren aztarnak eta bestetik, bioteknologia- eta farmazia-aplikazio berrietarako bideak aurkitzea posible izan daiteke.
Biziaren aurreko kimikaren eboluzioa
Bizia lurrean duela 3.800 milioi urte inguru agertu zen, eoi hadearraren amaieran. Ordurako, ura likido egoeran izateko adina hoztua zen Lurarren tenperatura. Ur likidoarekin batera, Lurrera bildutako planetesimal eta meteoritoetatik zetozen mineralez osatutako kontinenteak zeuden.
 Lurrak eoi hadearrean (gutxi gora-behera bizia agertu zen garaian) honelako itxura izango zuen. (Irudia: Peter Sawyer;
Smithsonian Institutua)
Lurrak eoi hadearrean (gutxi gora-behera bizia agertu zen garaian) honelako itxura izango zuen. (Irudia: Peter Sawyer;
Smithsonian Institutua)
Lehenengo zelula bizidunak gaur egungoak baino askoz ere sinpleagoak izango ziren. Lehen zelula hauei protozelula deitzen diegu. Protozelulak, oinarrian, lipido besikulak izango ziren ziurrenik eta barnean, besteak beste, molekula katalizatzaileak eta informazio gordailu moduan funtziona zezaketen molekulak egongo ziren. Izatez, posible da bi funtzio hauek molekula mota berdinek bete izana. RNA molekula batzuek esaterako bi funtzioak bete ditzakete eta hori dela-eta RNA nagusi zen garai bat izan zela proposatu da: RNA mundua.
Beraz, protozelulak osatzeko lipidoak behar ziren eta bai azido nukleikoak ere. Hauek nondik agertu ziren ulertzeko, kontuan izan behar da Lurrera meteorito ugari iristen zirela garai hartan eta mineralez gain, sustantzia organiko ugari ere bazekartzatela. Gainera, errekazio kimikoak etengabe ari ziren gertatzen eta bide hauetatik guztietatik ager zitezkeen Lurrean lipidoak eta mononukleotidoak. Lipidoek berez sor ditzakete besikulak ur ingurunean, eta mononukleotidoetatik abiatuz polinukleotidoak (RNA esaterako) sintetiza daitezke. Baina nola elkartu ziren hauek guztiak lehen protozelulak sortzeko?
Galdera honi erantzuteko, lehenengo azido nukleikoak nola sortu ziren argitu behar da. Azido nukleikoak sortzeko, mononukleotidoek kondentsazio erreakzioen bidez polimerizatu egin behar dute. Kondentsazio erreakzio hauetan bi molekula elkartu, eta (normalean) ur molekula bat kanporatzen da. Ur-disoluzioan ordea, dagoeneko ur asko dago inguruan eta ez da erraza besterik gabe ur molekula bat kanporatzea. Bestalde, garai hadearrean zeuden ur masen ertzetako gune batzuk tarteka urpean, tarteka lehor egongo ziren. Gune horietan, urak ekarritako mononukleotidoak kontzentra zitezkeen.
Mononukleotidoak besterik gabe lehortuz gero, solido amorfoak osatzen dituzte. Bestalde, mononukleotidoekin batera lipidoak lehortzen badira, lipidoek fase solido multilamelarra (hau da, geruza anitzekoa) osa dezakete, mononukleotidoak tartean hartu eta ordenatu egin ditzakete. Egoera honetan, mononukleotidoen mugikortasuna gutxitua dagoen arren, bi dimentsiotan (lipido geruzen artean) mugitzeko difusio gaitasunari eusten diote; lipidoen fase multilamelarra ingurune lehorrean ere fluidoa da-eta. Honela, mononukleotidoak elkarrekiko distantzia eta orientzaio egokian jar daitezke eta nahastea lehor dagoenez, kondentsazioz polimerizatu.
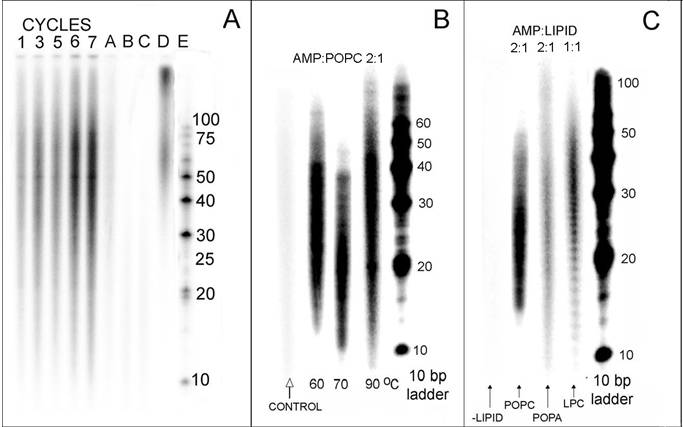 Lipido eta mononukleotidoak elkarrekin jarri, CO2 atmosfera batean lehortu eta berotuz esperimentu ezberdinetan lortutako
polinukleotidoen analisia ageri da ondoko irudian. 32P erabiliz markatutako produktuak ikus daitezke PAGE geletan.
Lipido eta mononukleotidoak elkarrekin jarri, CO2 atmosfera batean lehortu eta berotuz esperimentu ezberdinetan lortutako
polinukleotidoen analisia ageri da ondoko irudian. 32P erabiliz markatutako produktuak ikus daitezke PAGE geletan.
Goiko irudian ageri dira laborategian egindako saioen emaitza batzuk. Lipidodun ingurunean mononukleotido ez aktibatuen erreakzioz polinukleotidoak sor daitezkeela ikusi genuen eta erreakzio nahasteari aurretik polinukleotido bat gehituz gero, sintetizatzen den polinukleotido berriak guk jarritakoarekiko sekuentzia osagarria duela. Hau da: baldintza hauetan sekuentzia informazioa polinukleotido batetik bastera pasa daitekeela ikusi genuen.
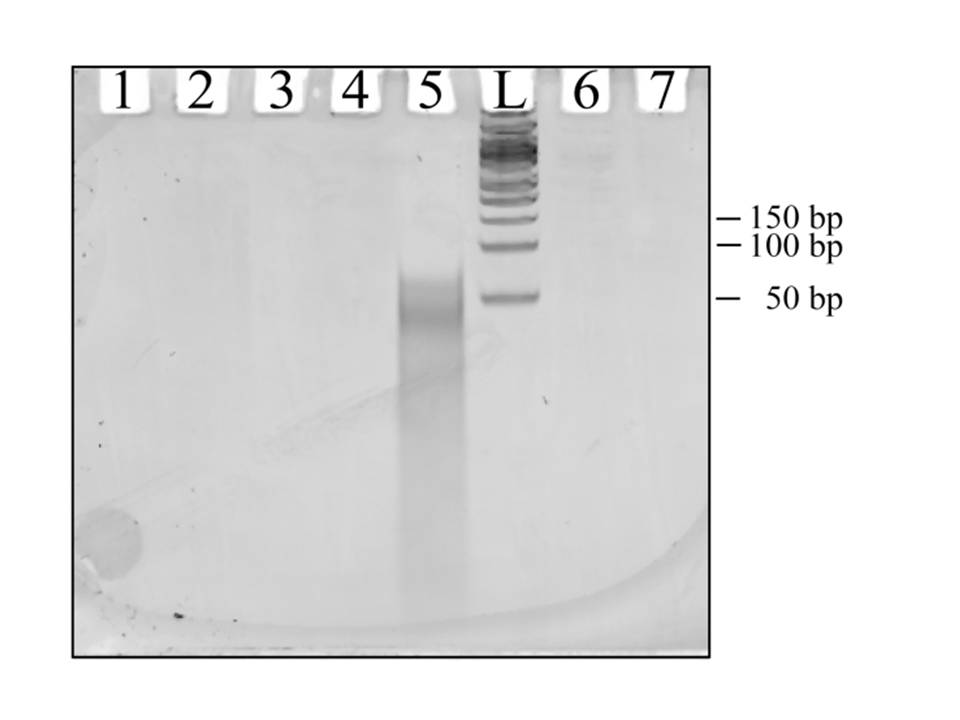 Erreakzio prebiotikoaren produktua eta txantiloi eran jarritako polinukleotidoa era espezifikoan zenbateraino hibridatzen diren
aztertzeko egindako PAGE ez desnaturalizatailea: L: 50 bp-tik 1350 bp-rako neurri-markatzailea; 1: Monomeroak (dNMP-ak) besterik ez;
2: dNMP-ak + txantiloi-polinukleotidoa, baina erreakzio ziklorik ez; 3: Produktua, txantiloirik gabe; 4: Produktuaren eta
txantiloi-polinukleotidoaren hibridatze ez-espezifikoa; 5: Produktuaren eta txantiloi-polinukleotidoaren hibridatze espezifikoa;
6: Lipidorik ez; 7: dNMP-ak + txantiloi-polinukleotidoa, baina erreakzio ziklorik edo lipidorik ez. Ikusten denez, hibrido
espezifikoa da nabarmen agertzen den bakarra. Kasu honetan, txantiloi modura jarritako polinukleotidoaren luzera 64 nukleotidokoa
zen eta irudian ageri denez, produktuen banaketak ere gutxi gora-behera luzera hori du goiko muga.
Erreakzio prebiotikoaren produktua eta txantiloi eran jarritako polinukleotidoa era espezifikoan zenbateraino hibridatzen diren
aztertzeko egindako PAGE ez desnaturalizatailea: L: 50 bp-tik 1350 bp-rako neurri-markatzailea; 1: Monomeroak (dNMP-ak) besterik ez;
2: dNMP-ak + txantiloi-polinukleotidoa, baina erreakzio ziklorik ez; 3: Produktua, txantiloirik gabe; 4: Produktuaren eta
txantiloi-polinukleotidoaren hibridatze ez-espezifikoa; 5: Produktuaren eta txantiloi-polinukleotidoaren hibridatze espezifikoa;
6: Lipidorik ez; 7: dNMP-ak + txantiloi-polinukleotidoa, baina erreakzio ziklorik edo lipidorik ez. Ikusten denez, hibrido
espezifikoa da nabarmen agertzen den bakarra. Kasu honetan, txantiloi modura jarritako polinukleotidoaren luzera 64 nukleotidokoa
zen eta irudian ageri denez, produktuen banaketak ere gutxi gora-behera luzera hori du goiko muga.
Beraz, sintesi-erreakzio hauei esker osatutako konposatuak lipidoen ondoan zeudenez, lipidoek beraiek osatutako besikuletan sartu eta denboraren buruan lehen protozelula egiturak osatuko zituzten. Egitura hauetan, konposatu ezberdinen sintesi eta degradazio abiadurek elkarren arteko erlazio egokiak behar zituzten sistema osoa zinetikoki egonkorra izan zedin. Sistema osoaren zinetika aztertzeko, funtsezko hainbat erreakzio planteatu eta hauen abiadurak ekuazio diferentzial arrunten sistema moduan adieraziz, sistema zinetikoki egonkorra izateko baldintzak azter daitezke.
Lipido-mintzen eta azido nukleikoen erabilera bioteknologikoa
Lipido-besikulak azido nukleiko eta bestelako sustantzien garraiatzaile
Lipidoek ur-ingurunean besikulak osa ditzakete eta besikula hauen barnean azido nukleikoak eta bestelako sustantziak sartu eta garraia daitezke. Medikamentuak eta bestelako sustantziak lipidoz osaturiko egituretan garraiatzea aspalditik erabili da estrategia moduan. Esaterako, sustantzia hauek gizakien gorputzeko organo edo ehun jakin batera iritsi behar duten medikamentuak baldin badira, lipidoek medikamentu hauek babestu egin ditzakete, iritsi behar duten tokira iritsi baino lehen degrada ez daitezen. Bestalde, behin beren helmugara iritsita, medikamentuak besikulatik atera eta organoan eragin behar du. Beraz, teknologia hau garatzean bi efektu hauen oreka bilatzen da: batetik, besikulen barnean dauden sustantziek ahalik eta gutxien atera behar dute bertatik beraien itura iritsi arte eta bestetik, behin hara iritsita, ahalik eta gehien atera behar dute egin beharreko efektua egin dezaten.
Oreka hau lortzeko estrategia bat besikulen kanpoaldean azido nukleikoak jartzea da. Proteinekin gertatzen den bezala, azido nukleikoek, sekuentziaren arabera, hiru dimentsiotako egitura ezberdinak har ditzakete eta honek itu ezberdinekin elkarrekintza jakinak izatea eragin dezake. Izatez, proteinak azido nukleikoak baino moldagarriagoak dira eta pentsa daiteke helburu honetarako egokiagoak izan daitezkeela. Hala ere, azido nukleikoekin in vitro lan egiteko dagoen teknika kopurua handiagoa da eta honek, azido nukleikoen erabilerari abantaila ematen dio. Esaterako, azido nukleikoak in vitro hautatzeko, SELEX izeneko prozedura erabil daiteke eta honela hautatutako molekulak besikulen kanpokaldean jar daitezke. Medikamentuak eragin behar duen ehunera iritsi bezain laster, besikuletako azido nukleikoek itu horrekin elkarrekintza espezifikoa izan dezakete eta honek barneko sustantziak askatzea eragin dezake.
Lipido-mintzak azido nukleikoen nanoporo-analisirako
Alpha hemolisina S. aureus bakterioak jariatzen duen toxina da. Eritrozitoen mintzetan sartuz, zuloak eragin eta zelula hiltzen du. Toxina honek eragindako zuloak doi-doi kate bakuneko azido nukleikoak pasatzen uzteko neurria du. Honi esker, azido nukleikoen analisia egin daiteke eta analisi klinikoetarako erabilgarri izatera ere irits liteke.
Toxina lipidoz osaturiko mintz batean sarrarazi eta mintzaren bi aldeetan potentzial elektrikoa ezarriz gero, disoluzioan dauden ioiek korronte elektrikoa sortzen dute eta korronte hau aparatu elektroniko egokiak erabiliz neur daiteke. Azido nukleikoak dituen lagin bat polo negatiboan jarriz gero, kanpotik ezarri den potentzial elektrikoak poroan zehar eramango ditu azido nukleiko molekulak. Poroa zeharkatzean, molekular horiek ioien bidea oztopatzen dute eta korronteak beherakada jasaten du momentu batez. Beherakada hau poroa blokeatzearen ondorio da eta azido nukleiko bakoitzak (edo azido nukleiko eta bestelako molekulen arteko konplexu bakoitzak) era ezberdinean blokeatzen du poroa. Beraz, korrontearen beherakada ere ezberdina da eta beherakada honetatik azido nukleikoaren (edo azido nukleikoak beste molekulekin osatutako konplexuen) propietateak azter daitezke. Bereziki, elkarrekintzen indarra azter daiteke, baina molekulen elkarrekiko posizioaren edo azido nukleikoen sekuentziaren gaineko informazioa ere eskura daiteke.
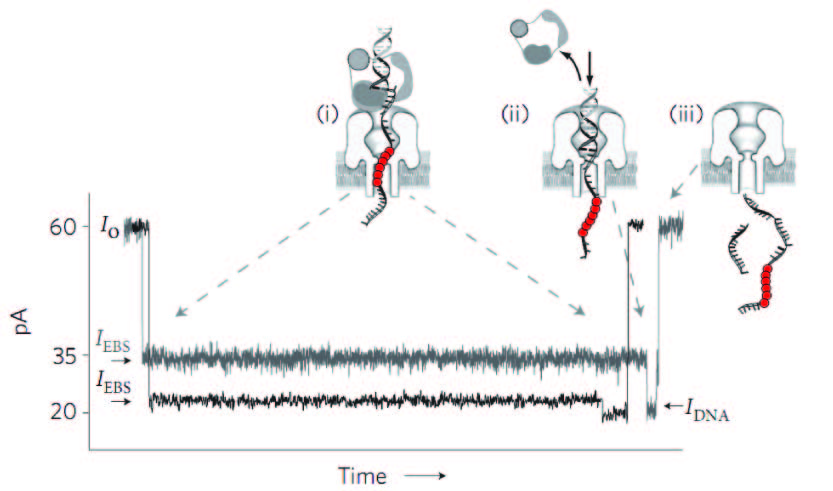 Nanoporo sisteman, konplexu molekular ezberdinek korronte elektrikoan nola eragiten duten erakusten du ondoko irudiak.
Nanoporo sisteman, konplexu molekular ezberdinek korronte elektrikoan nola eragiten duten erakusten du ondoko irudiak.
RNAren m6A metilazioa eta minbiziarekiko duen lotura
Kartzinoma duktal inbaditzailea (KDI) gaixotasun konplexu eta heterogeneoa da. Pronostiko eta prebalentzia ezberdina duten garrantzizko 5 azpimota daude: basala, A eta B luminala, B-HER2 luminala eta HER2 positiboa. Ikerketa lerro honetako taldeak erakutsi du nola zenbait DNAren metilazio patroi KDIren azpimota jakinekin erlazionatuak dauden. Hala ere, oraindik ez da aztertu RNAren metilazioak azpimota hauen garapenean duen eragina. N6-metiladesnosina (m6A) eukariotoen RNAko aldaketa arruntenetakoa da. Transkriptoma osoan zehar agertzen da eta ikusi da m6Aren aldaketak zenbait prozesu biologikorekin erlazionatuak daudela.
Modu berean, m6A sortu, kendu edo lotzen duten proteinak minbiziarekin eta beste zenbait gaixotasunekin erlazionatuak daude. Honela, RNAm-ren metilatzean eragiten duten mekanismoak hobeto ulertzeak m6Aren patroiarekin erlazionatutako terapia-itu eta metodo berriak topatzen lagun dezake. KIDren azpimota bakoitzak RNAm ezberdina izatea ere posible da.
Ikerketa lerro honetan KDIren zenbait azpimotatako tumore ehunetan m6Aren posizioak identifikatzea da helburua, gaixotasun honen aurka egiteko tratamenduak/terapiak topatzeko.
Parte-hartzaileak: Felix Olasagasti eta BIOMICS ikerketa taldeko kideak, Microfluidics eta BIOMICS clusterraren baitan.