1.- ¿Qué es la espectroscopia infrarroja [IR]?
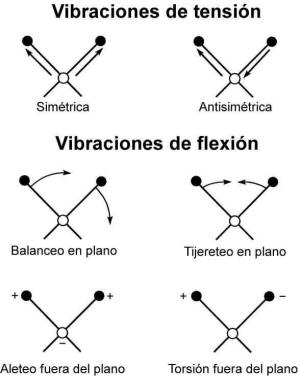
Pueden distinguirse dos categorías básicas de vibraciones: de tensión y de
flexión. Las vibraciones de tensión son cambios en la distancia interatómica
a lo largo del eje del enlace entre dos átomos. Las vibraciones de flexión
están originadas por cambios en el ángulo que forman dos enlaces. En
En principio, cada molécula presenta un espectro IR característico (huella dactilar), debido a que todas las moléculas (excepto las especies diatómicas homonucleares como O2 y Br2) tienen algunas vibraciones que, al activarse, provocan la absorción de una determinada longitud de onda en la zona del espectro electromagnético correspondiente al infrarrojo.
De esta forma, analizando cuales son las longitudes de onda que absorbe una sustancia en la zona del infrarrojo, podemos obtener información acerca de las moléculas que componen dicha sustancia.
[Arriba]
2.- ¿Qué información nos da la IR?
La espectroscopia infrarroja tiene su aplicación más inmediata en el análisis cualitativo: detección de las moléculas presentes en el material.
En la zona del espectro electromagnético IR con longitudes de onda del infrarrojo medio (entre 4000 y 1300 cm-1) se suelen observar una serie de bandas de absorción provocadas por las vibraciones entre únicamente dos átomos de la molécula. Estas vibraciones derivan de grupos que contienen hidrógeno o de grupos con dobles o triples enlaces aislados.
En la zona del espectro electromagnético IR con longitudes de onda comprendidas entre 1300 y 400 cm-1 (infrarrojo lejano), la asignación de las bandas de absorción a vibraciones moleculares es más difícil de realizar, debido a que cada una de ellas está generada por absorciones individuales sumadas (multiplicidad de las bandas). Es la denominada zona de la huella dactilar (flexión de enlaces CH, CO, CN, CC, etc..). En esta zona de longitudes de onda, pequeñas diferencias en la estructura y constitución de las moléculas dan lugar a variaciones importantes en los máximos de absorción.
En las tablas que visualizarás pinchando aquí encontrarás las bandas de absorción correspondientes a las moléculas orgánicas e inorgánicas más frecuentes.
[Arriba]
3.- Asignación de las bandas observadas de un espectro IR a las vibraciones moleculares
Consideremos que se ha sintetizado en el laboratorio un compuesto inorgánico-orgánico a partir de los siguientes componentes:
- Anhídrido arsénico trihidratado: As2O5·3H2O
- Sulfato de hierro (III) pentahidratado: Fe2(SO4)3·5H2O
- Cloruro de manganeso tetrahidratado: MnCl2·4H2O
- Ácido fluorhídrico: HF
- La molécula orgánica 1,3 diaminopropano: C3N2H12
Con esta síntesis lo que se pretende es obtener un arseniato de hierro y manganeso que contenga además la citada molécula orgánica. Para comprobar que el compuesto obtenido es el que buscamos, realizamos un espectro infrarrojo. En éste se deben observar las bandas de absorción de los enlaces As-O correspondientes al grupo arseniato (AsO4) y las de los enlaces N-H, C-H y C-N de la molécula orgánica. Además, en caso de que el compuesto contenga agua en la estructura, se observarán bandas de absorción del enlace O-H de la misma.
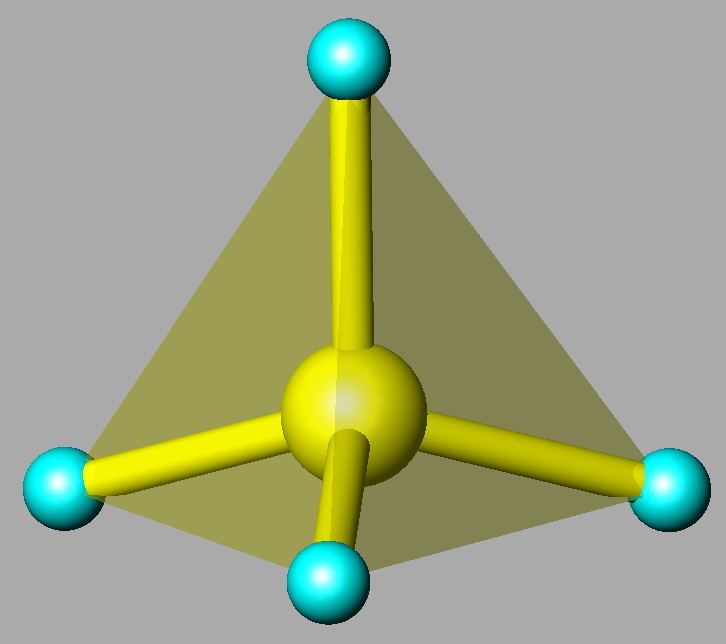 |
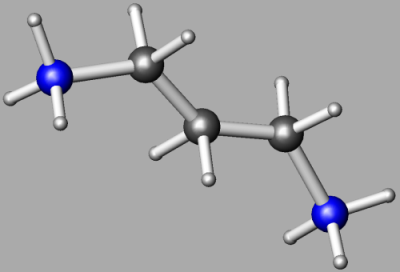 |
| Grupo arseniato AsO4 Las esferas azules representan los átomos de oxígeno |
Molécula orgánica 1,3 diaminopropano: C3N2H12. Las esferas grandes representan átomos de carbono (grises) o de nitrógeno (azules). |
En la siguiente tabla se muestra el intervalo de frecuencia de las bandas que se espera aparezcan en el caso de que la síntesis haya tenido éxito.
|
Intervalo de frecuencia (cm-1) |
Enlace |
Tipo de vibración |
|
3600-3200 |
O-H |
Tensión |
|
3500-3200 |
N-H |
Tensión |
|
3000-2800 |
C-H |
Tensión |
|
1600-1700 |
O-H |
Flexión |
|
1640-1550 |
N-H |
Flexión |
|
1400-1200 |
C-H |
Flexión |
|
1350-1000 |
C-N |
Flexión |
|
900-800 |
As-O |
Tensión (simétrica) |
|
700-750 |
As-O |
Tensión (antisimétrica) |
|
500-400 |
As-O |
Flexión |
El espectro de infrarrojo del compuesto se representa a continuación. En él se observan una serie de bandas de absorción (mínimos de transmisión o transmitancia) que se encuentran numerados del 1 al 10.

Espectro de IR del compuesto. La escala de las longitudes de onda es
logarítmica.
Comparando la posición de las bandas de absorción observadas en el espectro con la tabla de bandas esperadas, se puede realizar la asignación y comprobar los grupos moleculares presentes en nuestro compuesto:
|
Número |
Frecuencia (cm-1) |
Enlace |
Tipo de vibración |
|
1 |
3450 |
O-H |
Tensión |
|
2 |
3170 |
N-H |
Tensión |
|
3 |
2950 |
C-H |
Tensión |
|
4 |
1610 |
O-H |
Flexión |
|
5 |
1535 |
N-H |
Flexión |
|
6 |
1420, 1295, 1200 |
C-H |
Flexión |
|
7 |
1085 |
C-N |
Flexión |
|
8 |
820 |
As-O |
Tensión (simétrica) |
|
9 |
760 |
As-O |
Tensión (antisimétrica) |
|
10 |
470 |
As-O |
Flexión |
Como vemos, mediante la utilización de esta técnica podemos confirmar que el producto de la síntesis es el esperado, un arseniato que contiene la molécula orgánica, en este caso 1,3 diaminopropano.
[Arriba]
4.- Para saber más ...
- Nakamoto K., “Infrared and Raman Spectra of Inorganic and Coordination Compounds”, Ed. John Wiley & Sons, New York, 1997.
- Pretsch E., Clerc T., Seibl J., Simon W., “Tablas para la Elucidación Estructural de Compuestos Orgánicos por Métodos Espectroscópicos”, Ed. Alambra, 1988.
- Rubinson K.A., Rubinson J.F., “Análisis Instrumental”, Ed. Pearson Educación, 2000.
- Cómo vibran las moléculas y espectroscopía IR
- http://www.ugr.es/~quiored/espec/ir.htm
- http://es.wikipedia.org/wiki/Espectroscopia_infrarroja
- Apuntes sobre espectroscopía IR